В 33-х парсеках от Земли
Architec.Ton is a ecosystem on the TON chain with non-custodial wallet, swap, apps catalog and launchpad.
Main app: @architec_ton_bot
Our Chat: @architec_ton
EU Channel: @architecton_eu
Twitter: x.com/architec_ton
Support: @architecton_support
Last updated 3 weeks, 5 days ago
Канал для поиска исполнителей для разных задач и организации мини конкурсов
Last updated 1 month, 1 week ago

Короче, я несу вам великолепное - статью о том, что кошки это жидкость. Вы наверняка встречали умильные видосы, где кошки пытались пройти сквозь отверстия разного диаметра. Вот в этой статье авторы подошли к эксперименту со всей серьезностью...
The science is for cats!
Актуальная наука в рубрике #pubmed_энд_жизнь
1. Светится ли клетка тем, чем вы ее накрасили, и достаточно ли ярко?
1) "Ну, тут же есть канал для PacificBlue, значит, и BFP будет светиться," и "Но на приборе Х светилось..."
Не значит. Не любой макияж хорошо смотрится под конкретным софитом. Если у прибора нет подходящей для флуорохрома пары лазер+фильтр, как в случае стандартного сортера без УФ лазера и BFP, который эффективно возбуждается УФ лазером, но не фиолетовым лазером, то на выходе получите парочку стойких оловянных солдатиков в не очень дружной компании одноклеточных зомби. Надо заранее смотреть спектры возбуждения и эмиссии и уточнять параметры прибора.
В случае, когда шансы есть и хочется рискнуть, надо использовать краски на выживаемость, чтобы не заниматься некромантией. Кстати, одна линейка таких красок так и называется - Zombie.
2) "Клетки с люциферазой же должны светиться, если налить люциферин, потому что клетки ярко светились на люминометре".
Вообще-то нет, потому что если посмотреть спектр люциферина, то проблема та же, что с BFP, и вообще люминесценцию детектируют обычно в довольно широком диапазоне, в отличие от флуоресценции при цитометрии, поэтому тут сигнал будет очень слабым.
3) "Нам надо, чтобы два разных типа клеток с одинаковым геном/простором/... Х светились одинаково или конкретным образом".
Окей, ну наверное, только что там светится и что это даст? Если мажорный антиген или просто флуоресцентный маркер, то все получится. Если это более хитрый антиген или репортерный белок, то все очень зависит от свойств клеток: уровня экспрессии хитрого антигена и ответа (чувствительности) на стимул, необходимый для активации флуоресцентного сенсора.
В случае сенсорного белка нужно учитывать, светится ли он без активации. Если не светится без стимула, а мы им не приложили - снова получим популяцию зомби.
Выбор условий активации для сортировки - вопрос интересный, потому что в зависимости от интенсивности стресса могут включаться разные механизмы адаптации, и мы можем на входе получить линии с довольно разными свойствами.
4) "Я хочу проверить с помощью цитометрии, не подтекает ли индуцибельный промотор".
Если не забыть про зомби-краску, то значительное подтекание флуоресцентного маркера отсечь можно. Когда маркер слит с белком, регулируемым на уровне трансляции и деградации, то, вероятно, осмысленно добавить индуктор этого белка в отсутствии индукции промотора.
5) Не съела ли клетка метку?
Клетки имеют тенденцию со временем интернализовать поверхностные антигены и, таким образом, метки. Какие-то больше, какие-то меньше. Поэтому, если клетки позволяют, их полезно хранить после окрашивания на холоде.
6) "Мы гейтировали популяцию по неокрашенному контролю, а они не светятся".
При многоцветном окрашивании, когда возможен spillover - появление в канале лишнего сигнала от соседнего флуорохрома, - используют, помимо компенсации, FMO-контроль (fluorescence minus one) - образец, окрашенный всем, кроме данного антитела, и уже по нему выставляют гейт, поскольку настоящая отрицательная популяция может быть растянута/смещена вправо (spreading).
2. Не потерялись ли нужные клетки по дороге?
1) Если сортируется трансфекция или трансдукция, надо убедиться в оптимальности протоколов и выборе клеточной линии. Если нужна плохо трансфицируемая или трансдуцируемая линия, то надо или выбрать вторую, или настроиться на несколько сеансов обогащения ~~ЦКП и поставщиков~~ клеток.
2) Есть тысяча и один способ сломать и потерять клетки: убить их, центрифугируя в трипсине без сыворотки; потерять клетки из-за того, что они приклеились друг к другу или стенкам (с этим справляется BSA или сыворотка), или не учтя их природы: например, для сортировки неклассических моноцитов обогащать их стоит по пан-миелоидным маркерам, а не стандартным набором для выделения моноцитов.
Мертвые клетки не страшны для сортировки, но они ее замедляют.
3) "Можно ли увеличить скорость?" При повышении скорости подачи образца эффективность в какой-то момент начинает падать: программа не успевает анализировать события, или клетки чаще попадают в одну и ту же каплю.
Новый хэштег #FAQs_про_FACS - вопросы от пользователей. И немножко #профессиональное_подгорание - куда ж без него, пока сидишь и сортируешь маленькую популяцию клеток ~~без термоса с глинтвейном~~...
Так что сегодня о том, почему приходится долго сортировать - почему бывает мало целевых клеток.
В одних случаях это просто жизнь, но чаще это, хм, нюансы планирования: дореволюционные методики ("все так делают, поэтому просто обязано получиться") или инновационные идеи ("так никто не делает, но просто обязано получиться").
Так вот, если клеток мечты мало, помогут ~~старые советские~~ следующие вопросы...
P. S. Можно, кстати, задать их мне анонимно через ботик, и я их разберу!
Продолжаем, наконец, про #профессиональное_подгорание. Сейчас будут довольно очевидные вещи - но с другой стороны, ведь пригорает же!
Первое, о чем хочется сказать, - это плохое представление о том, какой параметр нужно оценить. В начале каждого эксперимента, поправив фуражку, задаешь три вопроса:
1) Какой параметр (биологический) хочется оценить?
2) Какой параметр (технический) получится померить с помощью выбранной методики? Как на этот параметр повлияют воздействия на него?
3) Как эти два параметра коррелируют и при каких условиях?
В качестве примера будет снова цитометрия. Мне как оператору хочется, чтобы в ТЗ были ответы на следующие вопросы:
1) технические: сколько клеток светится; что в них, собственно, светится; насколько ярко ~~и вообще будет ли~~ будет светиться; не будет ли светиться что-то, что нам мерить не надо;
2) биологические: что нам надо оценить и как интенсивность коррелирует с нужным параметром. Отсюда вопросы, нужно ли нам различие в интенсивности флуоресценции или процент положительных клеток, сколько параллелей; в случае сортировки какие популяции выравнивать по яркости и надо ли это делать.
А конкретнее:
1.1) Надо проверять наличие флуоресценции у веществ, которыми клетки обрабатываются и у оцениваемого красителя и их длины волн. Танцы с бубном с поиском нужной комбинации лазера-канала и компенсацией могут спасти, а могут и не спасти. Если светятся, необходимы обработанные контроли без красителя для успокоения души или компенсации.
Надо заранее уточнять, есть ли нужная комбинация на приборе. Например, лазер 405 нм толком не возбуждает BFP, и в силу его низкой яркости хорошо светятся только почившие клетки, поэтому или ищем прибор с УФ лазером, или вместо BFP используем, например, tagBFP.
1.2) Процент клеток. Если это не окраска антителами и не трансфекция для CRISPR, а, скажем, стабильная культура и при этом нужных клеток меньше 1%, я, скорее всего, предложу сделать две сортировки: одну "черновую", в режиме обогащения (yield), при котором нужные клетки не потеряются, но попадут ненужные; а затем сорт "набело" в режиме purity. Если это трансфекция с CRISPR, то, вероятно, осмысленнее отсортировать в планшет по 1 клону. Ну или запастить терпением, книгами, пушистым пледом и ~~коньяком~~ валенками, а потом все равно сортировать по 1 клону.
1.3) Вопрос, ярко ли светятся - тоже понятно. В случае трансфекции обычно большой разброс и в целом относительно яркий сигнал, в случае трансдукции - по-разному. В случае трансфекции имеет смысл брать максимум достоверно светящихся клеток, а в случае лентивирусной трансдукции предпочитаю не брать слишком бледные и яркие клетки. Если имеем слабый сигнал, может иметь смысл покрасить на выживаемость viability dye, чтобы узнать, есть ли за гейтом кто живой, и не тратить время на сортировку почивших клеток.
С выбором и комбинацией красок чуть сложнее. Если оставить в стороне особенности окрашивания панелью антител, то все просто: в случае, когда краски светят в соседние каналы, я попрошу клетки для single-stained и FMO контролей, которыми любят пренебрегать, о чем потом расскажу отдельно.
Второй пункт уже касается, собственно, темы поста. Мы измеряем интенсивность флуоресценции, и надо знать, отчего она будет зависеть.
В случае сортировки флуоресцентных маркеров мне надо знать, флуоресцентный маркер экспрессируется ли сам по себе или он слит с другим геном, он находится под управлением конститутивного промотора или индуцибельного, изменяется ли его экспрессия при определенных воздействиях (репортер ли он).
1) В самом простом случае, когда ген флуоресцентного белка сам по себе и экспрессируется постоянно, все просто и приятно: сортируем то, что светится.
2) Если это флуоресцентный сенсор, то как минимум, необходимо, чтобы разброс сигнала без воздействия был минимальным, а как максимум - чтобы разброс сигнала в ответ на воздействие тоже был минимальным и чтобы при этом разрешение было хорошим, но сохранялся биологический смысл.
Отдельный разговор - экспрессия мишеней, окрашенных антителами, особенно при иммунофенотипировании, ее разберем отдельно.
 Heilung, где сама мелодия …](/media/attachments/bri/brilliant_violet/1817.jpg)
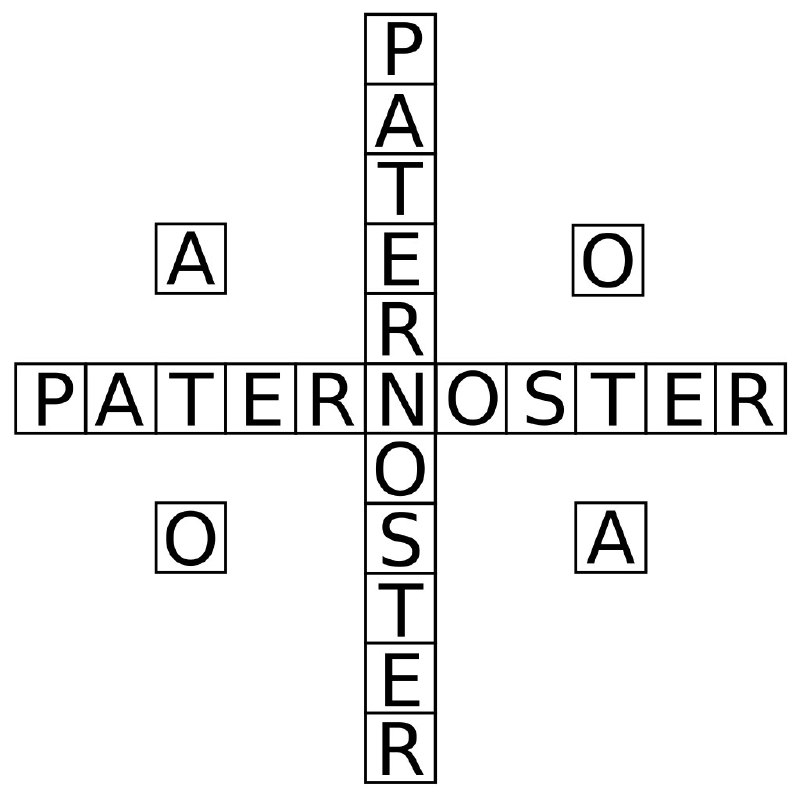
Упомянутая композиция Heilung, где сама мелодия написана как палиндром на основе кода, который, как они пишут, они получили на основе цифр, рун и букв в этом квадрате.


Architec.Ton is a ecosystem on the TON chain with non-custodial wallet, swap, apps catalog and launchpad.
Main app: @architec_ton_bot
Our Chat: @architec_ton
EU Channel: @architecton_eu
Twitter: x.com/architec_ton
Support: @architecton_support
Last updated 3 weeks, 5 days ago
Канал для поиска исполнителей для разных задач и организации мини конкурсов
Last updated 1 month, 1 week ago